PLAN DE APOYO NUTRICIONAL
- Evitar el Desgaste Proteico Energético
- Preservar el estado nutricional y la masa muscular
- Evitar mayores alteraciones metabólicas
- Brindar soporte al sistema inmunológico
- Disminuir el estado inflamatorio
- Mejorar la actividad antioxidante y la función endotelial.
- Reducir la mortalidad.
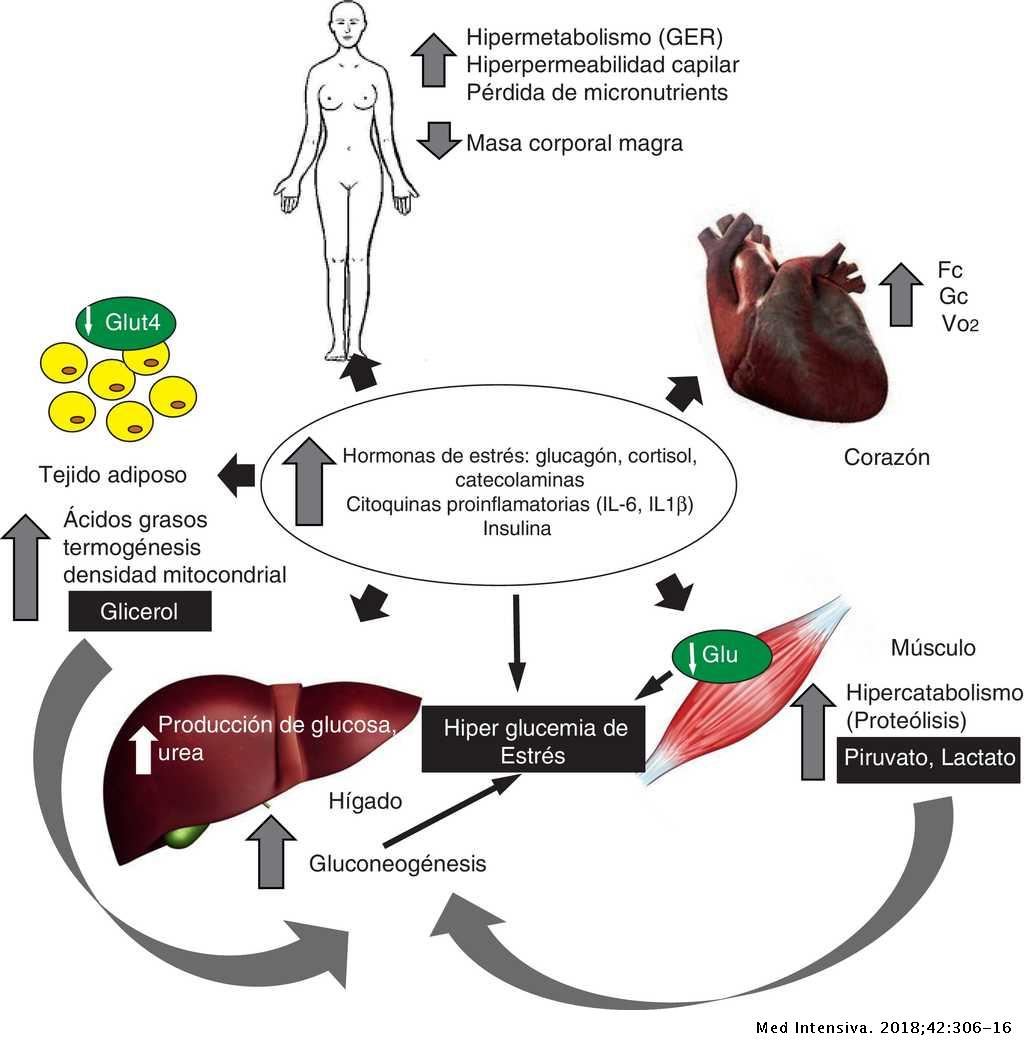
El soporte nutricional del fracaso renal agudo guarda relación con el catabolismo de la enfermedad de base, con el tipo de tratamiento efectuado, con la técnica de reemplazo renal utilizada y con la presencia de malnutrición previa.
El catabolismo y el tratamiento son determinantes para la composición de la nutrición artificial:
- los enfermos con catabolismo normal reciben tratamiento conservador.
- los pacientes estables con un catabolismo moderadamente incrementado son tratados con hemodiálisis intermitente
- los que muestran una situación hipercatabólica son tratados con técnicas continuas de reemplazo renal.
1. TRATAMIENTO CONSERVADOR
¿Cuáles son las necesidades
proteicas y las características de su aporte?
El aporte se debe realizar con aminoácidos esenciales
y no esenciales, recomendándose dietas (orales o nutrición enteral)
hipoproteicas (hasta 1,0 g de proteínas/kg/día) con al menos un 20% de
proteínas de alto valor biológico. No se recomiendan los aportes exclusivos de
aminoácidos esenciales e histidina.
¿Cuáles son los requerimientos
energéticos ?
Las dietas o mezclas utilizadas serán ricas en
hidratos de carbono para limitar la hiperpotasemia, la hiperfosfatemia y la
hipermagnesemia habituales de estos enfermos.
Se recomiendan aportes de 25 kcal/kg de peso/día, con dietas bajas en colesterol, siendo el aporte de lípidos < 1,2
g/kg/día. La aparición de hipertrigliceridemia limita la cuantía del aporte
calórico.
¿Qué aportes de electrolitos y de
micronutrientes ?
Control electrolítico:
En el tratamiento conservador es
precisa una estrecha vigilancia del aporte de sodio así como controlar la
hiperpotasemia, la hipermagnesemia, la hiperfosfatemia y la acidosis
metabólica.
2. HEMODIÁLISIS Y DIÁLISIS PERITONEAL
¿Cuáles son las necesidades
proteicas y las características de su aporte?
Permitir un aporte proteico sin restricciones, pero inducen pérdidas que obligan a aumentar los requerimientos. Aunque el grado de catabolismo proteico es muy variable de unos pacientes a otros, suele tratarse de pacientes con un hipercatabolismo moderado.
La hemodiálisis intermitente
provoca una pérdida de aminoácidos y péptidos de 8-12 y 1-3 g, respectivamente,
en cada sesión. Además, dependiendo de la biocompatibilidad de los filtros,
puede aparecer un aumento de la respuesta inflamatoria.
La diálisis peritoneal induce unas pérdidas proteicas diarias
de 13-14 g de proteínas, que pueden incrementarse a 18-20 g si aparece
irritación peritoneal y superar los 100 g en peritonitis grave.
Se recomiendan aportes de 1,2-1,4 g de proteínas/kg/día en la hemodiálisis y de 1,2-1,5 g/kg/día en la diálisis peritoneal. Las dietas y las mezclas de aminoácidos estándar suelen ser adecuadas en la mayoría de los enfermos.
¿Cuáles son los requerimientos
energéticos?
La hemodiálisis induce pérdidas de glucosa, unos 25 g
por sesión, mientras que la diálisis peritoneal, dependiendo de la
concentración de glucosa o de poliglucosa del líquido de diálisis utilizado,
provoca un importante ingreso de glucosa y de lactato, que debe ser considerado
a la hora de cuantificar los aportes. Es importante la edad de los pacientes y,
en mayores de 65 años, no deben superarse las 30 kcal/kg/día
¿Qué aportes de electrolitos y de micronutrientes ?
En el tratamiento conservador y en la hemodiálisis
intermitente (y en general en todos los sistemas que utilizan exclusivamente el
mecanismo de difusión), la hiperfosfatemia es muy frecuente. El soporte
nutricional deberá ser bajo en fosfatos.
3.TÉCNICAS CONTINUAS DE REEMPLAZO
RENAL
APORTE DE PROTEÍNAS
Las técnicas continuas de reemplazo renal se aplican a fracasos renales hipercatabólicos que precisan aportes de 1,3-1,5 g de proteínas/kg/día, a los que deben añadirse las pérdidas secundarias a la técnica utilizada.
En hemofiltración arteriovenosa continua y en
hemofiltración venovenosa: pérdidas
diarias de 10-15 g de aminoácidos en el ultrafiltrado, con balance negativo de
glutamina (ya que ésta representa el 16% de los aminoácidos del ultrafiltrado).
En los pacientes sépticos se realizan técnicas de hemofiltración de alto
flujo), con pérdidas superiores.
Se debe aportar 1,5 g de proteínas/ kg/día y se
recomienda dar aportes de 2,2-2,5 g/kg/día, sobre todo en hemofiltración
continua de alto flujo
REQUERIMIENTOS ENERGETICOS
Las más utilizadas son la hemofiltración venovenosa
continua, que precisa una gran cantidad de líquido de reposición, y la
hemodiafiltración venovenosa continua, que requiere perfusiones de líquido de
reposición y de diálisis. Frente a unas pérdidas diarias obligadas de 25 g de
glucosa, los líquidos de reposición y de diálisis inadecuados pueden inducir
enormes aportes de glucosa y de lactato. Se recomiendan soluciones sin glucosa
o con 1 g de glucosa/l, con bicarbonato como buffer.
El aporte energético se ajustará al nivel de estrés.
Siendo casi siempre situaciones clínicas hipercatabólicas, el aporte proteico
debe ser alto, con baja relación calorías/nitrógeno, limitando las necesidades
energéticas a 25-35 kcal totales/kg/día.
APORTES DE ELECTROLITOS Y DE MICRONUTRIENTES
ELECTROLITOS:
Las técnicas continuas de reemplazo renal basadas en
el mecanismo convectivo inducen grandes pérdidas de fosfatos. Los líquidos de
reposición son bajos en fósforo para evitar sus interacciones con el calcio y
el bicarbonato. Es imprescindible una estrecha vigilancia de los valores
séricos de fósforo para detectar hipofosfatemias graves y realizar los
suplementos correspondientes.
MICRONUTRIENTES:
SELENIO: Hay un descenso en los valores de selenio en
los pacientes críticos, con y sin fallo renal. Debido a su efecto antioxidante
se aconseja aportes altos en los pacientes con técnicas continuas de reemplazo
renal, aunque pueden inducir intoxicación por selenatos.
EL CINC está
bajo en los pacientes críticos, y su déficit se acentúa con la hemofiltración
continua. Debe ser suplementado, aunque las dosis estándar son suficientes
LAS VITAMINAS HIDROSOLUBLES : deben aportarse a dosis
estándar en el tratamiento conservador y en la diálisis intermitente y dosis
doble en los pacientes con técnicas continuas. El temor a inducir oxalosis con
la administración de megadosis de vitamina C, limitando su aporte a 50 mg/día,
explica los bajos valores de esta vitamina (de gran importancia antioxidante)
en los enfermos críticos, que se agrava con la hemofiltración continua. Son
frecuentes bajos valores de tiamina a pesar de los suplementos.
LAS VITAMINAS
LIPOSOLUBLES deberán administrarse a dosis estándar, aunque en los fracasos
renales en tratamiento conservador o en hemodiálisis intermitente conviene
reducir la dosis de vitamina A.
video nutrición en la enfermedad renal
video de terapias de remplazo renal en paciente crítico.